КЕТЕНЫ
Формально кетены можно рассматривать как внутренние
ангидриды монокарбоновых кислот. Простейшим соединением этого ряда является
собственно кетен. Из его формулы выводят структуры альдокетенов и кетокетенов:
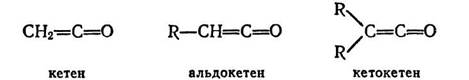
Кетены со времени их открытия Штаудингером (1905 г.)
стали ценным материалом для органического синтеза. В последние годы большое
значение приобрели также галогенкетены.
Номенклатура. В основе номенклатуры кетенов лежит название родоначального
соединения. Например:

Производные кетенов могут быть также названы и как
производные кетонов:

Физические
свойства и природа связей. Кетены в
обычных условиях являются газами или желтоватыми жидкостями с острым запахом.
Вещества малостабильны.
В
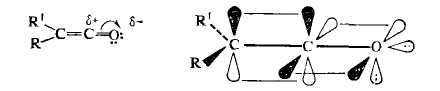
молекуле кетенов углеродные атомы кетеновой группировки находятся в состоянии
sp2- и sp-гибридизации (структура типа алленов). Кетены являются
электрофильными реагентами, электрофильный центр находится на sp-гибридизованном
углеродном атоме:
Получение
кетенов
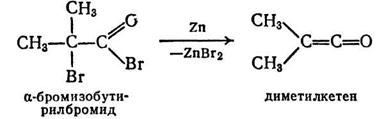
(1). Дегалогенирование
a-галогенацилгалогенидов. a-Галогенацил-галогениды при действии цинка в диэтиловом эфире
превращаются в кетены;
(2).
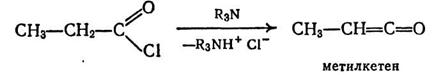
Дегидрогалогенирование ацилгалогенидов.
В присутствии третичных аминов ацилгалогениды подвергаются дегидрогалогенированию:
Реакции
кетенов
Кетенами, как и ангидридами карбоновых кислот, можно
проводить ацилирование. В этом отношении они превосходят во много раз ангидриды
и галогенангидриды карбоновых кислот. Эти реакции протекают по следующему
механизму:
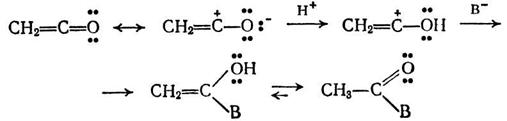
Стадией, определяющей скорость реакции, является атака
нуклеофила В-. Ниже приведены примеры реакций подобного типа:
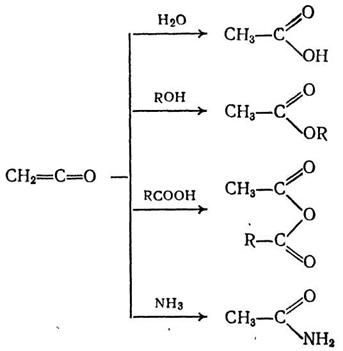
Чрезвычайно высокая карбонильная активность кетенов
объясняется особенностями их строения. Строение кетенов напоминает строение
алленов: π-связи в них расположены во взаимно перпендикулярных плоскостях,
вследствие чего частичный положительный заряд на карбонильном атоме углерода не
компенсируется.
Следует заметить, что кетен реагирует также и с
карбонильными соединениями, способными к енолизации, с образованием ацетатов
енолов. Так, из ацетона образуется изопропенилацетат:
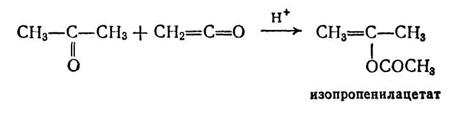
Изопропенилацетат в кислой среде, в свою очередь,
может употребляться как мягкое ацетилирующее средство.
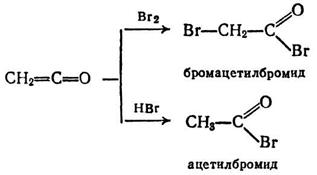
Кетены проявляют также типичные свойства ненасыщенных
соединений. Так, они присоединяют бром с образованием a-бромацилбромидов или галогеноводороды с образованием
ацилгалогенидов:
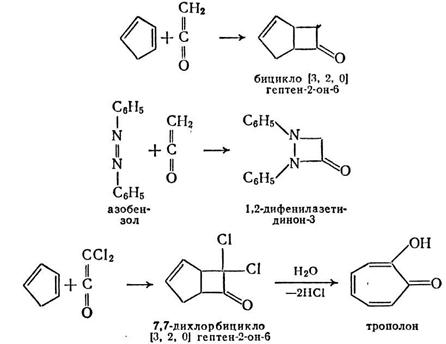
Особый интерес представляют реакции
[2+2]-циклоприсоединения по двойной и тройной связи, которые ведут к
гетероциклическим соединениям с четырехчленным циклом. В качестве примеров
следует привести реакции кетена с циклопентадиеном‑1,3 и азобензолом, а
также присоединение дихлоркетена к циклопентадиену.
Последняя из названных реакций является первым этапом
чрезвычайно простого синтеза трополона.
Важнейшие
кетены
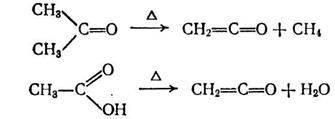
Кетен получают пиролизом ацетона или уксусной кислоты при
700 °С в присутствии фосфатных катализаторов (AlPO4):
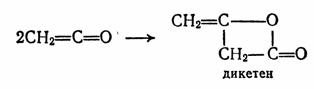
Кетен представляет собой бесцветный, в высшей степени
ядовитый газ (т. кип. ‑41 °С). Он устойчив при - 80 °С, выше этой
температуры легко димеризуется в дикетен (β-лактон-β-оксивинилуксусной
кислоты, бутен-3-олид-1,3):
Дикетен представляет собой бесцветную жидкость с
резким запахом (т. кип. 127 °С). При нагревании до 500—600 °С он
распадается с образованием кетена. Дикетен применяют для получения производных
ацетоуксусной кислоты.
Дифенилкетен образуется из азибензила при перегруппировке Вольфа.
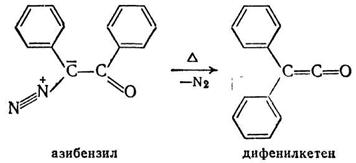
Он представляет собой оранжевую жидкость, которую
можно перегнать в вакууме без разложения. В отличие от кетена он не склонен к
димеризации.