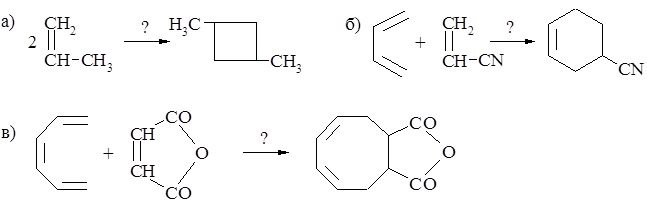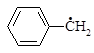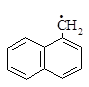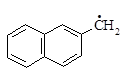Задачи и упражнения по спецкурсу «Теория реакционной способности органических соединений»
1. Корреляционный анализ органических реакций
При выполнении заданий этой темы используйте Приложение (http://kochem.samsu.ru/pril.htm) и таблицы раздела «Реакционная способность органических соединений» в Справочнике химика т. III, c. 935: http://kochem.samsu.ru/OX_doc/chem_tom3.djvu.
Для построения графиков можно использовать on-line сервис: http://www.yotx.ru/default.aspx.
1.1. Определите константы диссоциации карбоновых кислот X-COOH, где Х=H, CH3, COOH, C6H5, COCH3, NHCH3. Постройте графики зависимости: а) lgK – s; б) lg(K/Ko) – s.
1.2. Cравните кислотность м- и п-замещенных бензойных кислот ХC6H4COOH, где Х = H, CH3, Cl, ОCH3, NO2, NH2, ОH. Укажите порядок возрастания кислотных свойств.
1.3. Установите влияние заместителей на скорость гидролиза м- и п-замещенных бензилхлоридов (заместители: CH3, Cl, Br, NO2, NH2, ОCH3). Сделайте выводы о возможном механизме этой реакции.
1.4. Сравните кислотность в ряду: а) спиртов X-CH2-OH; б) м-, п-замещенных фенолов X-C6H4-OH, где X=H, CH3, Cl, NO2. Сделайте общие выводы о кислотных свойствах спиртов и фенолов.
1.5. Используя полуэмпирическую схему Q-e (см. Приложение), определите параметры сопряжения (Q) и полярности (e) для акрилонитрила CH2=CHCN (М2) по известным константам его сополимеризации со стиролом (М1): r1 = 0,37; r2 = 0,07.
1.6. Рассчитайте константы сополимеризации стирола (M1) и акриловой кислоты (M2) по схеме Q-e, если Q1 = 1; e1 = -0,8; Q2 = 1,51; e2 = 1,06.
1.7. Определите r1 и r2 для пары акрилонитрил – акриловая кислота (при необходимости используйте данные задач 1.5 и 1.6).
1.8. Чему равны константы сополимеризации, если е1 = е2 = 0; Q1 = 1; Q2 = 0,5?
1.9. Какое строение будет иметь сополимер, если Q1 = Q2; е1 = 1; е2 = -1?
1.10. Расположите следующие мономеры в порядке уменьшения активности в реакции катионной полимеризации:
|
Мономер |
Q |
e |
|
метилметакрилат |
0,74 |
0,40 |
|
стирол |
1 |
-0,8 |
|
a-метилстирол |
0,98 |
-1,27 |
|
винилацетат |
0,026 |
-0,22 |
1.11. Укажите порядок возрастания относительной реакционной способности мономеров М2 при радикальной сополимеризации с винилхлоридом (М1), если известно:
|
М2 |
r1 |
r2 |
|
акрилонитрил |
0,02 |
3,28 |
|
бутен-1 |
3,4 |
0,22 |
|
винилацетат |
1,68 |
0,23 |
|
пропен |
2,25 |
0,29 |
|
стирол |
0,02 |
17 |
1.12. Определите различие в скоростях реакций присоединения винилхлорида и винилиденхлорида к радикалу метилметакрилата (М1) по следующим данным:
|
М2 |
r1 |
r2 |
|
винилхлорид |
13 |
0 |
|
винилиденхлорид |
2,53 |
0,24 |
2. Расчет p–электронных систем по методу Хюккеля
2.1. Рассчитайте энергию сопряжения в молекуле бутадиена-1,3.
2.2. Определите p–электронную энергию циклобутадиена.
2.3. Сравните относительную устойчивость аллильных и циклопропенильных структур:

2.4. Определите коэффициенты атомных орбиталей в молекулярных орбиталях: а) бутадиена-1,3; б) аллила; в) циклопропенила; г) циклобутадиена.
2.5. Произведите расчет порядков p-связей и зарядов на атомах для аллил-катиона, аниона и радикала.
2.6. Определите порядки p-связей в молекуле триметиленметана. Что означают понятия «максимальное связывание» и «индекс свободной валентности»?
2.7. Рассчитайте молекулярные диаграммы а) бутадиена-1,3; б) аллил-катиона (аниона, радикала); в) циклопропенил-катиона; г) циклобутадиена.
2.8. Используя прикладную программу «МОХ» (скачать, 230 Кб), рассчитайте p–электронную энергию и молекулярные диаграммы бициклобутадиена (пропалена), бициклогексатриена (буталена), фульвена, бензола.
2.9. Постройте в p–электронном приближении вековые детерминанты и найдите полиномы для молекул: а) винилхлорида, б) винилбутилового эфира, в) пиррола.
2.10. Дайте сравнительную характеристику реакционной способности толуола, фенола, анилина и бензальдегида на основе статического метода, используя программу «HyperChem».
2.11. Рассчитайте энергию локализации атомов в молекуле бутадиена-1,3 и сделайте вывод о его реакционной способности.
2.12. Определите на основании расчета Lr+, по какому из атомов метиленциклопропена будет происходить электрофильная атака.
2.13. Рассчитайте энергии электрофильной, нуклеофильной и радикальной локализации атомов углерода в молекуле: а) пиррола; б) пиридина. Укажите наиболее вероятное направление соответствующих реакций замещения. На основании полученных результатов дайте сравнительную характеристику пиррола и пиридина в реакциях электрофильного замещения (при расчетах используйте программу «МОХ»).
3. Расчет p–электронных систем методом возмущений молекулярных орбиталей
3.1. Определите коэффициенты несвязывающей p–молекулярной орбитали для следующих структур: а) аллил, б) пентадиенил, в) бензил, г) дифенилметил.
3.2. Рассчитайте распределение зарядов: а) в анионах a- и b-нафтилметила; б) катионах тривинилметила и трифенилметила.
3.3. Запишите выражение несвязывающей молекулярной орбитали для бензильного радикала и изобразите вид (атомно-орбитальную модель) этой орбитали.
3.4. Используя RS-способ, определите относительную устойчивость следующих структур, содержащих равное число sp2-гибридизованных атомов углерода:
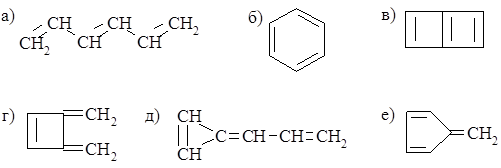
3.5. Определите наиболее устойчивое соединение, образованное связыванием метила и гептатриенила.
3.6. Дайте характеристику ароматичности следующих структур:
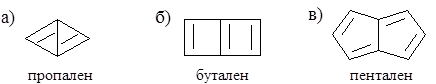
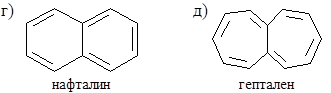
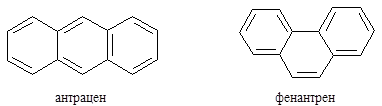
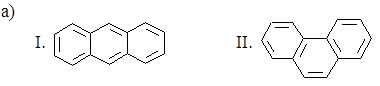
3.7. Сравните ароматичность центральных циклов в антрацене и фенантрене:
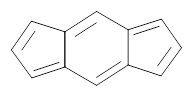
3.8. С помощью RS-способа определите устойчивость индацена:
3.9. Определите наиболее вероятное направление реакции электрофильного замещения в молекуле нафталина, сравнив энергии локализации атомов углерода в a- и b-положениях.
3.10. Оцените преимущественное направление реакции при мононитровании дифенила.
3.11. Определите направление электрофильного ароматического замещения в антрацене и фенантрене, используя индексы реакционной способности динамического метода.
3.12. Используя внутримолекулярное связывание, оцените устойчивость следующих моноциклических неальтернантных углеводородов:

3.13. Рассчитайте полную p-электронную энергию следующих молекул:
а) этилен; г) нафталин;
б) циклобутадиен; е) симм-дифенилэтилен;
в) бутален; ж) азулен;
д) дифенил; з) антрацен.
Для расчета используйте данные табл. 3.1, полученные по методу МО ЛКАО.
Таблица 3.1. p-Электронные энергии альтернантных радикалов
|
Название радикала |
Структурная формула |
p-Электронная энергия |
|
Аллил |
|
3a + 2,818b |
|
Пентадиенил |
|
5a + 5,46b |
|
Гептатриенил |
|
7a + 8,05b |
|
Нонатетраенил |
|
9a + 10,63b |
|
Бензил |
|
7a + 8,72b |
|
a-Нафтилкарбинил |
|
11a + 14,49b |
|
b-Нафтилкарбинил |
|
11a + 14,27b |
3.14. Оцените относительную устойчивость следующих изомеров:
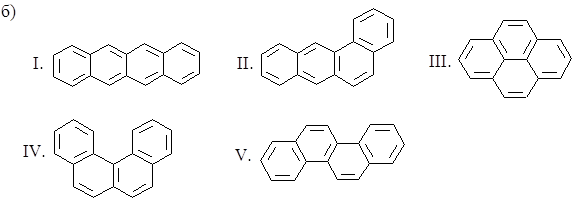
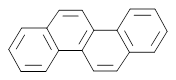
3.15. В каком направлении преимущественно будет происходить электрофильное замещение в молекуле хризена:
4. Применение принципа сохранения орбитальной симметрии
4.1. Постройте корреляционные диаграммы и определите условия конротаторной и дисротаторной циклизации гексатриена-1,3,5.
4.2. Определите стереохимический путь реакции и строение образующегося продукта:
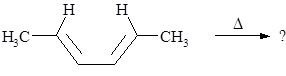
4.3. Какой продукт образуется в результате реакции:
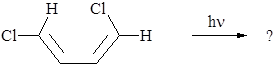
4.4. Укажите условия, необходимые для следующего превращения:
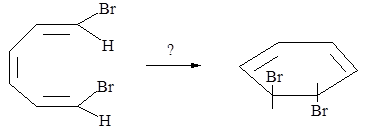
4.5. Какие условия требуются для превращений:
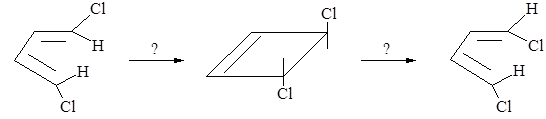
4.6. Классифицируйте тип переходного состояний (хюккелевский или мёбиусовский) следующих перициклических реакций и укажите условия для их осуществления:
а) конротаторная циклизация гексатриена-1,3,5;
б) дисротаторная циклизация гексадиена-2,4;
в) циклодимеризация этилена;
г) циклоприсоединение этилена к бутадиену;
д) циклодимеризация бутадиена.
4.7. Используя концепцию «ароматического» переходного состояния, проанализируйте реакции циклоприсоединения: